| 0人浏览 | 2024-04-25 07:53 |
Pluvicto是核药赛道近几年当之无愧的“明星产品”。
据诺华财报披露,Pluvicto 2023年以260%的增幅实现9.8亿美元销售收入,距离成为10亿美元“重磅炸弹”级别药物仅一步之遥。Pluvicto是目前为止年销售额最高的放射性治疗药物,也是在上市销售的次年便实现了这一壮举。
过去几年,在Pluvicto治疗突破及商业化成功的带动下,全球核药赛道发展势头强劲。融资方面,医药魔方MedAlpha 数据库显示,2021-2023年,全球核药赛道累计融资超60亿美元,2023年融资金额较2022年上涨了82%,寒冬之下彰显赛道活力;BD方面,核药赛道大额交易频发,诺华、拜耳、罗氏、礼来等巨头加速布局步伐;市场方面,Pluvicto上市不到两年,销售额直逼10亿美元赋予了核药赛道市场空间最直观的想象力。
从2022年3月凭借亮眼数据被FDA率先批准用于治疗PSMA阳性去势抵抗性前列腺癌,到获批上市后商业化表现高歌猛进,Pluvicto的成功进一步加强了诺华“全球核药王者”的地位。而回首诺华的“成王之路”,要从两起关键收购说起。
全球核药王者的“成功之路”
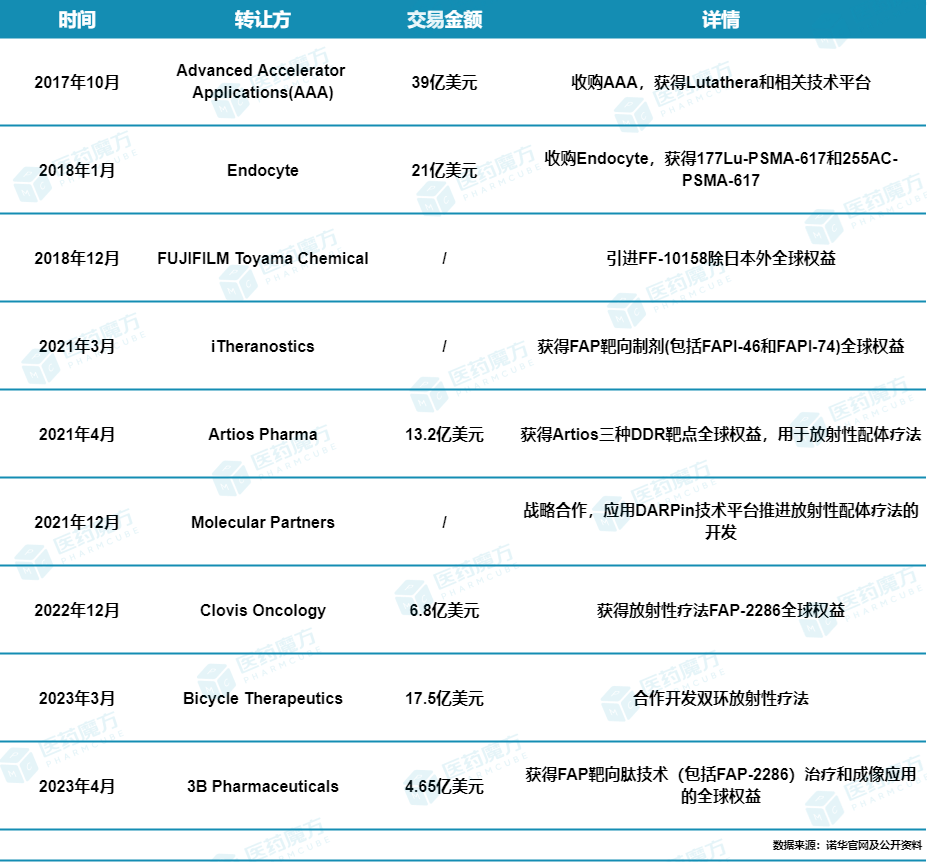
早在2017年,诺华就以39亿美元的价格收购Advanced Accelerator Applications(AAA),获得了放射性配体药物Lutathera(177Lu-dotatate)和相关技术平台;次年,又斥资21亿美元收购Endocyte,获得Pluvicto(177Lu-PSMA-617)和255AC-PSMA-617的权益。
这两起颇具前瞻性且眼光精准的收购让诺华在放射性配体疗法(Radioligand Therapy,RLT)赛道拥有了两款极具竞争力的药物——Lutathera和Pluvicto。其中,Lutathera是全球首款获批上市的RLT药物,开启了放射性药物靶向治疗新时代。
与碘化钠、氯化镭等上一代核素药物不同,新一代RLT药物(也被称为RDC)与抗体偶联物(ADC)同属偶联药物,结构相似,一般包含四部分:
- 靶向分子(molecular binder),负责精准识别和结合肿瘤靶点;
- 连接子(linker),负责连接靶向分子和螯合剂,同时改善整体药物分子的药学应用;
- 螯合剂(chelator),负责牢固络合放射性核素;
放射性同位素(radioisotope),负责显像或治疗肿瘤。
得益于这样的结构以及独特的作用机理,RLT具有多重优势,与ADC相比,RLT无需内化和水解linker的过程;与传统小分子/大分子药物相比,RLT药物治疗机制清晰,不仅能在高效精准治疗的同时降低对其他组织造成的损伤,还能避免耐药性。此外,RLT药物是目前临床实操中唯一能够实现诊疗一体化的药物。
Lutathera于2017年9月获EMA首批,用于治疗不可切除或转移性、进展性、分化良好(G1及G2)、生长抑素受体阳性的胃肠胰神经内分泌瘤成人患者,随后于2018年1月获FDA批准上市。
全球神经内分泌肿瘤新发病例数已从2017年30.69万人增长到2020年32.29万人,预计到2030年新发病例数将增长至35.16万人,存在巨大的治疗未满足空间。上市首年,Lutathera的销售额就达到了1.67亿美元,次年增长至4.41亿美元,在最新的2023年财报中,Lutathera已实现6.05亿美元的销售额。
Pluvicto于2022年3月获FDA批准上市,用于接受雄激素受体途径抑制剂(APRI)和紫杉醇化疗的前列腺特异性膜抗原(PSMA)阳性转移性去势抵抗性前列腺癌(mCRPC)成人患者。Pluvicto的获批基于一项关键性III期临床试验(VISION),结果显示,晚期PSMA阳性mCRPC患者的标准治疗加入Pluvicto,可显著延长影像学无进展生存期(rPFS,8.7 vs 3.4个月)和总生存期(OS,15.3 vs 11.3个月)。
Pluvicto的商业化成功来得更加迅猛,首年全球销售额达2.71亿美元,2023年销售额跃升至9.80亿美元,预定“重磅炸弹药物”俱乐部席位。
Lutathera和Pluvicto的上市奠定了诺华在核药领域的领导者地位,而诺华在核药赛道的快速进展和可观的销售数据,反过来也带动了全球核药市场的火热,为行业发展注入了强心剂。
值得一提的是,诺华仍在积极拓展两款已上市明星产品的临床价值,Lutathera和Pluvicto正在从末线治疗往前线走,探索核药的更大空间。
2023年10月,诺华在ESMO年会上公布了Pluvicto治疗既往接受过ARPI且PSMA阳性mCRPC患者的III期PSMAfore研究结果。数据显示,试验达到主要终点,在未经化疗的mCRPC患者中展现出超过两倍的影像学无进展生存获益。针对不良事件的分析显示,177Lu-PSMA-617的安全性更优,3-4级不良事件(33.9% vs. 43.1%)和严重不良事件(20.3% vs. 28.0%)的发生率均低于ARPI组。这些结果有望推动Pluvicto向一线治疗进军。诺华近期也再次更新,PSMAfore研究全人群OS数据结果积极,预计于2024提交新的上市申请。
Lutathera同样收获了好消息。2024年1月,诺华在ASCO-GI会议上公布了Lutathera一线治疗胃肠胰神经内分泌瘤(GEP-NETs)III期临床NETTER-2的最新临床数据:主要终点mPFS从8.5个月延长至22.8个月,延长至近3倍,疾病进展或死亡风险降低72%,总响应率ORR高达43%,表明Lutathera一线治疗SSTR阳性、2/3级GEP-NETs的III期临床NETTER-2研究达到了PFS主要终点和ORR关键次要终点。这些积极数据为RLT在癌症领域治疗获益带来了更大的想象空间。
Lutathera和Pluvicto的成功让诺华迅速在核药赛道占据高地,同时也更加坚定了诺华在核药赛道进一步开疆辟土的决心。除进一步开发已上市的两款RLT药物外,诺华还有包括177Lu-FAP-2286、177Lu-NeoB、225Ac-PSMA-617在内的多款在研RLT产品
- 177Lu-FAP-2286(AAA614)靶向成纤维细胞激活蛋白(FAP),目前正在实体瘤中开展I/II期临床研究;
- 177Lu-NeoB1靶向胃泌素释放肽受体(GRPR),目前正在乳腺癌、脑角质瘤及其他实体瘤等适应症中进行I/II期临床研究;
225Ac-PSMA-617和Pluvicto一样靶向PSMA,但选用的是杀伤力强、射程短的α核素,在前列腺癌治疗中可以发挥更大的优势,目前正在进行I期临床研究。
诺华在研RLT管线
在潜力项目177Lu-FAP-2286的首次人体试验(NCT04939610)中,研究人员探索了肽靶向放射性核素疗法(Peptide Targeted Radionuclide Therapy,PTRT)的可行性及初步剂量。11例晚期胰腺癌、乳腺癌、直肠癌、卵巢癌患者经68Ga-FAP-2286或68Ga-FAPI-04 PET/CT确认摄取后,接受177Lu-FAP-2286治疗。结果显示,177Lu-FAP-2286在原发和转移性肿瘤病变中具有高摄取和长时间滞留以及可接受的辐射剂量和治疗副作用,可广泛应用于多种肿瘤。该研究首次为177Lu-FAP-2286在不同类型腺癌PTRT治疗方面的可行性提供了临床证据。
内部管线研发持续发力之外,过去几年,诺华在核药赛道的BD战略依然出众,2021年以来,通过多项合作,获得多款RLT候选药物和研发平台。以2023年为例,3月,诺华宣布与Bicycle Therapeutics达成17.5亿美元合作,开发基于双环肽的放射性偶联药物(Bicycle Radio-Conjugates);4月,诺华又与3B Pharmaceuticals达成4.65亿美元合作,获得其FAP靶向肽技术(包括FAP-2286)治疗和成像应用的全球权益。不难看出,在BD方面的不断深入,是诺华应对当前核药赛道激烈竞争,巩固其核药赛道领导者地位的关键策略。
诺华在核药领域的代表性合作并购
此外,由于放射性同位素的半衰期较短,核药的商业化放量一直受到产能桎梏。诺华的Pluvicto有效期从工厂包装好开始计时只有5天;Lutathera更短,只有3天,这让全球分散建厂成为刚需。
诺华目前已陆续在意大利、西班牙和美国分别设立了放射性药物生产基地,以满足全球患者需求。今年1月,FDA已批准诺华在印第安纳波利斯的生产基地进行Pluvicto的商业化生产。这座7万平方英尺的工厂是诺华最大且最先进的核药生产基地,位于美国中心,毗邻Fedex(联邦快递),12小时即可触达全美病人,能最大限度地为患者和治疗中心提供服务。
为了能给医疗卫生机构、医生及患者提供更优质的服务,诺华还独立出品了一系列包括医疗卫生系统建设、药物预定、物流追踪、RLT技术支持、医学教育培训在内的全方位客户服务系统和产品,致力于为医患提供全方位的服务。诺华对RLT的决心,可见一斑。
从产品,到管线、产能、商业化,毫无疑问,诺华已经将RLT变成了自己的主场。在JP Morgen2024大会上,CEO Vas Narasimhan对诺华在RLT领域的布局表现出十足的底气,他表示:“放射性配体疗法有望成为诺华建立长期领导力的赛道。”
从深耕中国,到建立核药帝国
放射性药物产业在中国已成为国家重点支持的战略性新兴产业。近几年,国内陆续出台了《医用同位素中长期发展规划(2021-2035年)》、《放射性体内治疗药物临床评价技术指导原则》、《国家药监局关于改革完善放射性药品审评审批管理体系的意见》等利好政策,助力核药产业发展。
其中,2023年4月发布的《国家药监局关于改革完善放射性药品审评审批管理体系的意见》指出,鼓励以临床价值为导向的放射性药品创新,鼓励境外已上市原研放射性药品在我国境内进口注册,并提出将对临床急需的放射性药品上市许可申请给予优先审评审批。
诺华的中文名取意“承诺中华”,即通过不断创新的产品和服务,提高中国人民的健康水平和生活质量。作为开发RLT的先驱和领导者,为满足中国患者需求,过去几年诺华进行了多元化布局。
为推动Pluvicto在中国获批上市,诺华已在国内开展多项临床试验。其中,针对转移性激素敏感性前列腺癌的一项III期研究(CTR2022147)及针对PSMA阳性转移性去势抵抗性前列腺癌的一项II期研究(CTR20230317)均已完成患者招募。
此外,2023年12月,诺华宣布在浙江海盐投资设立一家全新的放射性药物生产基地,以加快将创新型RLT药物引入中国的步伐,造福有临床需求的国内肿瘤患者。该基地的投资总额预计将超过6亿元人民币,将在2026年底投入生产。临床及生产的双重好消息预示着Pluvicto将加速进入中国。
除了推进产品获批、商业化,2024年4月21-22日,由中国同位素与辐射行业协会主办的2024年放射性药物创新发展大会暨中国同位素与辐射行业协会放射性药物分会第一届理事会第一次会议宣布,诺华正式成为放射性药物分会副会长单位。此前,该协会会员单位均为国内公司,诺华作为跨国药企的首次加入,既体现了中国核药产业发展的开放性,也体现了诺华与中国核药产业进一步融合的决心。
此前,在2024年中国发展高层论坛(CDF)上,诺华CEO Vas Narasimhan也强调了公司在RLT赛道的领先地位,并就加快RLT这一先进疗法的开发与应用积极建言,同时分享了诺华的洞察与实践。诺华在RLT领域的丰富积淀及经验将为中国核药产业发展注入新势能。
明星产品、潜力管线的加持,以及生产、运输、医患服务等资源的建置与支持,让诺华登上了全球核药赛道之巅。紧跟中国核药产业发展大势,深度布局中国这一关键市场无疑是诺华志在将RLT打成公司新王牌产业的关键策略。诺华在RLT领域的战略决心与持续布局,正助力其逐步建立“核药帝国”,进一步延续、加强其核药全球王者地位;同时,也将推动全球核药产业迎来新的里程碑,书写新的篇章。
注:文章素材来自公开资料
- 暂时还没有人评论
-
0
-
0
-
TOP