| 0人浏览 | 2024-04-24 18:08 |
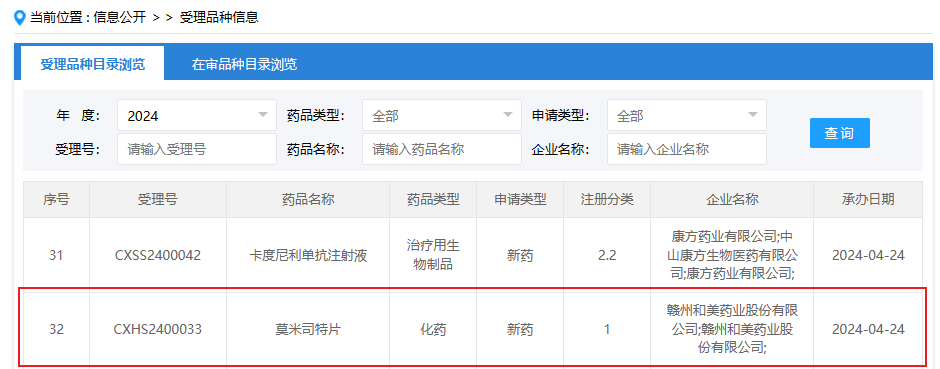
4月24日,CDE网站显示,和美药业的莫米司特(Hemay005)申报上市。根据临床试验进展,推测此次申报的适应症为斑块状银屑病。
莫米司特是和美药业开发的一款靶向磷酸二酯酶4(PDE4)的小分子抑制剂。PDE4可通过调节细胞内cAMP和/或cGMP水平控制下游多种炎症因子的产生,因此PDE4靶向药物在多种炎症相关疾病中均有不错的治疗效果。
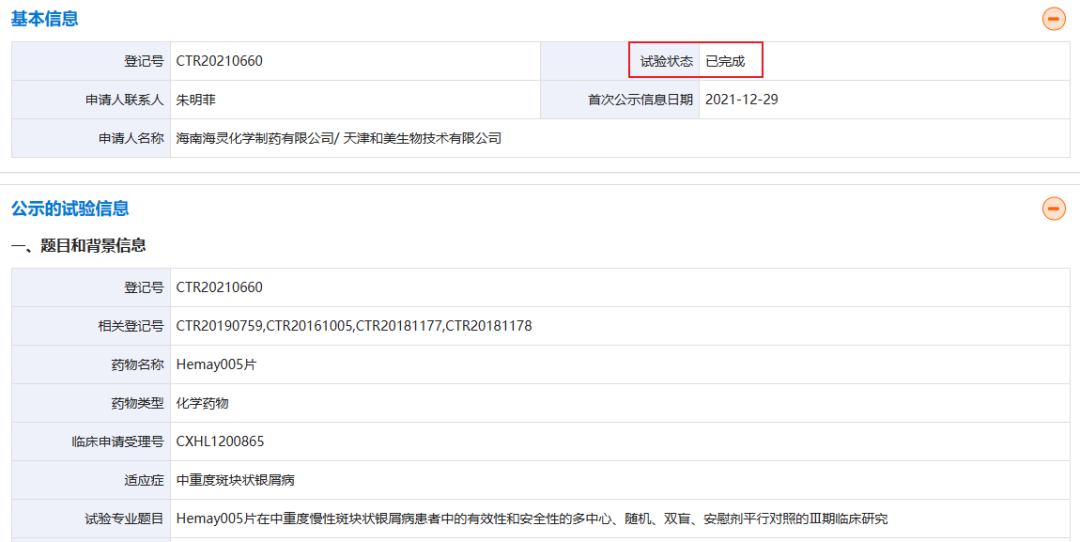
2016年12月,莫米司特首次进入临床阶段。截至今日,和美药业就该药物已开展两项III期临床试验,针对的适应症分别为斑块状银屑病和白塞氏病。其中,莫米司特(60mg,每日2次)治疗斑块状银屑病的III期研究的状态已于今年1月30日变更为“已完成”,结果尚未公布。
来源:药物临床试验登记与信息公示平台
2023年11月,和美药业在美国风湿病学会(ACR)大会上公布了莫米司特治疗白塞氏病的II期研究结果。该研究是一项多中心、随机、双盲、安慰剂对照临床试验(n=90),评估了莫米司特(45/60mg,每日2次)对比安慰剂治疗白塞氏病患者的有效性和安全性。
完整分析集(FAS)结果显示,莫米司特60mg(单侧,P<0.0001)和45mg(单侧,P<0.0001)在减少口腔溃疡数量方面的疗效显著优于安慰剂。基于KM法预估口腔溃疡的中位愈合时间:45mg组为16天,60mg组为15天,安慰剂组的中位愈合时间无法通过KM方法估算。
安全数据集(至少接受1剂药物或安慰剂的患者)中,在12周的核心治疗期间,与研究药物相关的治疗相关不良事件(TEAEs)导致停药的发生率在45mg组和60mg组分别为6.9%和6.7%,均高于安慰剂组(0.0%)。核心治疗期所报告的大多数TEAEs为轻度。严重TEAEs的发生率与剂量有关,60mg组为3.3%,45mg组和安慰剂组均为0%。
目前,全球已有7款选择性PDE4抑制剂获批上市,这些药物均为海外产品。其中,仅阿普米司特片(安进/)和罗氟司特软膏(Arcutis/华东医药)可用于斑块状银屑病的治疗,但仅阿普米司特片在中国获批。据医药魔方Nextpharma数据库统计,包括莫米司特在内的5款PDE4抑制剂正处于III期临床阶段,其中仅莫米司特为中国药企自主研发的PDE4抑制剂。莫米司特有望成为首款获批上市的国产PDE4抑制剂。
- 暂时还没有人评论
-
0
-
0
-
TOP